
PCM-Handwärmer
Hotpack aus Natrium-Acetat
Wasserbett
Kimasoft
Prospekt Klimasoft /
Original-Bilder
PCM-Detail-Erklärungen

Vorgang animiert
darstellen
Aqua
Dynamic-Hotpack / grosses Bild
Inhalt / Zusammensetzung: Natriumacetat, Wasser. Nicht gefährlich, nicht giftig.
Normale Methode: Hotpack in Microwelle legen und ca. 2 Minuten bei Stufe AUFTAUEN (ca. 350W). Nach ca. 1 Minute unterbrechen und durchkneten, nach 2 Minuten schütteln bis völlig transparent. Es muss verhindert werden, dass der Rand der zuerst flüssig wird, überhitzt und und die Aussenhülle schmilzt! Ev. nochmals 10-20 Sekunden in den Mikro legen. Erst stoppen und abkühlen lassen wenn alle Kristalle geschmolzen sind!
Schnelle Methode: Hotpack in Microwelle legen und ca. 20 Sekunden bei höchster Stufe. Herausnehmen und durchkneten. Es muss verhindert werden, dass der Rand der zuerst flüssig wird überhitzt und und die Aussenhülle schmilzt! Wieder 20 Sek. Micro, durchkneten etc. erst stoppen und abkühlen lassen wenn alle Kristalle geschmolzen sind, wenn völlig transparent!
Sichere Methode / ohne Mikrowelle: In Pfanne ca. 4 Minuten kochen, Stoff
/ Tuch auf den Pfannenboden legen da Hotpack-Hülle sonst am heissen
Pfannenboden schmelzen könnte und zerstört würde.
Dann
abkühlen lassen.
Aufbewahren: Das Thermo-Pad sollte im flüssigen Zustand gelagert werden. Ansonsten findet eine leichte Konzentration der Flüssigkeit durch Verdunsten statt. Die Wirksamkeit nimmt dadurch ab.
Auslösen / Aktivieren: Das Keramik-Stäbchen etwas
knicken und der Kristallisations-Vorgang beginnt.
[Andere Modelle:
Metallscheibe durchdrücken wodurch ein Knackgeräusch erzeugt wird.
Die Schallwelle verdichtet die Flüssigkeit und löst den
Kristallisations-Vorgang aus. Andere Theorie: Beim Biegen werden Mikrorisse im
Material erzeugt die den Vorgang auslösen.]
Das Hot-Pack kann auch als Cool-Pack verwendet werden, da es bis -9°C flüssig bleibt !
Thermo-Pad / Sodium Acetat - supercool liquid, 54°C / 130°F. Es handelt sich um durch PCM (phase change material) freigesetzte Energie. Mit dem Thermo-Pad kann das Prinzip des PCM auf dramatische Weise vermittelt werden.
PCM-Material ist ein Bestandteil von Tafelsalz/Essig (Sodium Acetat Trihydrate) welches bei 54°C / 130°F fest wird.
Durch die Verpackung wird das Kristalisieren jedoch verhindert und die Flüssigkeit kann zu einer superkalten Flüssigkeit werden, dh. unter den "Gefrierpunkt" sinken. Erst bei ca. -9°C / 23°F wird der Vorgang durch die Temperatur selbst ausgelöst. Bei wärmeren Temperaturen wird ein äusserer Einfluss, z.B. knicken eines Keramik-Stiftes oder der Metallscheibe zur Auslösung des Vorganges benötigt. Da dieser Wechsel von flüssig zu fest immer bei 54°C stattfindet erwärmt sich die Materie auf diese Temperatur.
Aehnliches kann festgestellt werden wenn eine geschlossene Cola auf einige Minusgrade gekühlt wird und dabei oft nicht gefriert. Beim Oeffnen des Behälters gefriert die Cola dann sofort und wird dabei 0°C "warm".
Das Hotpack wird ansonsten z.B. als Körperwärmer (z.B. auch beim Tauchen), Babyfood-Wärmer, Muskelpackung etc. angewandt und ist in div. Grössen und Formen erhältlich.
In der Natur wird auch ganz selten folgendes Phänomen festgestellt: Die Temperatur eines kleinen Sees sinkt auf Minusgrade ohne dass das Wasser gefriert, weil ein Kristallisierungs-Auslöser fehlte (Wasserbewegungen/Objekte im Wasser etc.). Jemand schlägt nun mit eine Stock ins Wasser etc. und der See gefriert innerhalb von Sekunden komplett zu.
Bei Defekt der Aussenhülle: PCM fest werden lassen, Hülle dann mit kleinem Flick und einem Tropfen Leim (Wasserbett-PVC-Flickset) reparieren.
Kosten Hotpack SFr. 5.- (nur über den Fachhandel)
1. Die grosse Energie-Aufnahme und Energie-Abgabe
beim Schmelz- und Verfestigungs-Vorgang (Gefrieren) [ = PCM-Effekt ]
Das
Hotpack bleibt bis zu 1 Stunde warm, da die ganze "Gefrier-Energie" bei
54°C abgegeben wird.
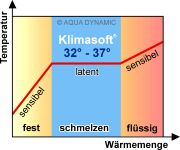
Der Klimasoft kann bei 32-37°C grosse Mengen
an überschüssiger Wärme aufnehmen ohne spürbar wärmer
zu werden wirkt so als Temperaturpuffer und verhindert dadurch ein
Schwitzen.
2. Der Vorgang lässt sich endlos wiederholen, nutzt
sich nicht ab = extrem ökologisch
Das Hotpack kann wieder
aufgeladen werden indem das Salz bei über 60°C im Mikro geschmolzen
wird.
Der Klimasoft macht das Aufladen sogar automatisch ohne
Energiezufuhr, da er, wenn der (zu) warme Körper von ihm entfernt wird
(Verlagerungen, Aufstehen etc.), sich bei unter 32° selber wieder
auflädt / fest wird, und so zum erneuten Schmelzvorgang bereit
ist.
 Grosses
Bild: Temperaturverhalten
Grosses
Bild: Temperaturverhalten
Die Energie der latenten Phase (beim Hotpack
das rückgängig gemachte Schmelzen von flüssig zurück auf
fest) wird als Wärme zurückgegeben.
Latente Phase =
grosse Energie-Aufnahme / -Abgabe ohne Temperatur-Veränderung die in
beiden Temperatur-Richtungen funktioniert (verfestigen und verflüssigen).
Die Energie wird benötigt um das Molekular-Gitter von fest auf flüssig
aufzusprengen bzw. die Wärme wird beim erstarren von flüssig auf
fest wieder frei.
Durch die latente Phase sind z.B. auch Eiswürfel
sehr effiziente Kühl-Objekte. Sie müssen durch grosse Energiemengen
zum Schmelzen "gezwungen" werden und kühlen so ein Getränk etc.
Mehr Details zu PCM
 Trotz
eisiger Kälte warme Hände: Kristallisationswärme von Salzen
macht es möglich. Wie funktionieren solche Taschenwärmer, die man
ganz leicht im Schullabor nachbauen könnte?
Trotz
eisiger Kälte warme Hände: Kristallisationswärme von Salzen
macht es möglich. Wie funktionieren solche Taschenwärmer, die man
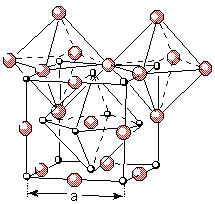
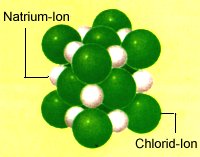
ganz leicht im Schullabor nachbauen könnte? Salze sind aus Ionen aufgebaut, etwa das gut bekannte Kochsalz (= Natriumchlorid) aus Natriumionen Na+ und Chloridionen Cl-. Im festen Zustand bilden Salze so genannte Ionengitter aus, in denen sich positive und negative Ionen regelmäßig anordnen. Aufgrund der elektrostatischen Anziehungskräfte zwischen positiven und negativen Ionen sind solche Gitter außerordentlich stabil.
 Das
Molekular-Gitter
Das
Molekular-Gitter
Wenn man ein Salz durch Erwärmen zum schmelzen
bringt, muss man daher beträchtliche Mengen an Energie aufwenden, die
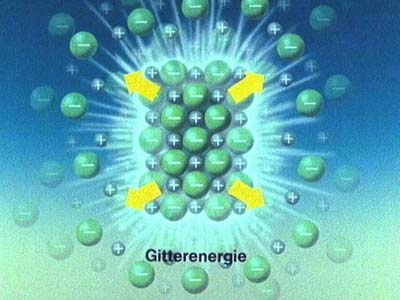
sogenannte Ionengitterenergie, um das Ionengitter zu zerstören. Umgekehrt
wird die Ionengitterenergie in Form von Wärme frei, wenn ein Salz vom
flüssigen zum festen Zustand erstarrt.
Eine Schmelze erstarrt normalerweise an ihrem Schmelzpunkt, etwa Wasser bei 0°C. Viele Flüssigkeiten kann man aber auch deutlich unterhalb ihres Schmelzpunkts abkühlen, ohne dass sie fest werden. Solche unterkühlten Schmelzen bezeichnet man als metastabil, da ihr Erstarren plötzlich einsetzen kann. Oftmals kann das Erstarren auch gezielt ausgelöst werden, etwa dadurch, dass man einen Kristallisationskeim - manchmal genügt ein Staubkorn - der Schmelze hinzufügt.
Die Kombination der oben beschriebenen Effekte, Freisetzung von Ionengitterenergie beim Erstarren eines Salzes und Unterkühlung von Schmelzen, kann man auf einfache, aber sehr effektive Weise für die Konstruktion einer Taschenheizung nutzen, die ohne Strom oder Feuer auskommt. Festes Natriumacetat, das Natriumsalz von gewöhnlichem Essig, wird bei 54°C flüssig, doch kann die Schmelze bis auf etwa -10°C abgekühlt werden, ohne dass sie wieder fest wird. Setzt der Erstarrvorgang jedoch ein, wird die Ionengitterenergie frei, und die Schmelze erwärmt sich bis zu ihrem Schmelzpunkt von 54°C und hält auch diese Temperatur, bis sie komplett erstarrt ist.
Der entscheidende Trick bestand noch darin, einen Auslöser für
das Erstarren des unterkühlten Natriumacetats zu finden, damit man die
Heizung auch nach Belieben anstellen kann. Dies wird dadurch erreicht, dass in
der Natriumacetatschmelze ein Stahlplättchen vorhanden ist, das beim
Knicken ein Geräusch macht, wie man es von den als Kinderspielzeugen
gebräuchlichen Knackfröschen kennt. Durch das Knicken entsteht also
eine akustische Welle, die durch die Schmelze läuft und sie für einen
kurzen Moment verdichtet. Dies genügt, um einen Kristallisationskeim zu
erzeugen und das Erstarren der Schmelze auszulösen.
Eine andere
Meinung ist, dass Mikrorisse im Metall den Vorgang auslösen.
Ebenfalls
gibt es als weitere Auslöser kleine längliche Metallfedern mit
Kunststoffhülle oder ein kleiner Keramikstift mit Kunststoffhülle
(ideal für Mikrowelle - ohne Metall) die geknickt werden
müssen.
Dabei steigt die Temperatur, wie oben erklärt, auf
wohlige 54°C für die Dauer des Erstarrvorgangs an, der bei den im
Handel befindlichen, handgroßen Taschenheizungen etwa ein bis zwei
Stunden in Anspruch nimmt. Der Taschenwärmer kann immer wieder benutzt
werden: Bringt man das Natriumacetat durch Erwärmen in kochendem Wasser
wieder zum Schmelzen, wird er wieder aktiviert. Beim Schmelzen wird das
Natriumacetat in sein Trihydrat umgewandelt.
In jedem Schullabor findet
sich Natriumacetat, so dass in Schulversuchen leicht unterkühlte Schmelzen
hieraus hergestellt und die hier beschriebenen Effekte beobachtet werden
können. Bei Temperaturen von -10°C darf man die Taschenheizung nicht
in der Kälte liegen lassen, da der Erstarrvorgang sonst von alleine
beginnt.
Quellen
Taschenheizung aus dem Schullabor, von Professor Oliver
Reiser
Prof. Dr. Blume,
Fakultät Chemie (Didaktik) der Universität Bielefeld
Temperatur-Verlauf (Grafik
der Wärmeabgabe)
Telekolleg Chemie des
Bayerischen Rundfunks
Die latente Wärmespeicherung
http://www.rubitherm.com/deutsch/pages/04a_waermespeicherung.htm
Es handelt sich um ein bekanntes, rein physikalisches Prinzip. Schmelzen und Verfestigen von Materialien [so genannter Wechsel des Aggregatzustandes] benötigt riesige Energiemengen, ohne dass sich die Temperatur massgeblich verändert. Will man zum Beispiel Eis bei 0 °C zu Wasser von 0 °C schmelzen, benötigt man die gleiche Energiemenge, wie wenn das Wasser von 0 °C auf 80 °C erhitzt werden soll. Im Klimasoft werden Mikrokapseln auf Paraffinbasis verwendet. Die Energieaufnahme dieser wachsähnlichen Paraffine, die bei 32 - 37 °C gestaffelt zu schmelzen beginnen, ist dreimal so hoch wie die von Wasser.
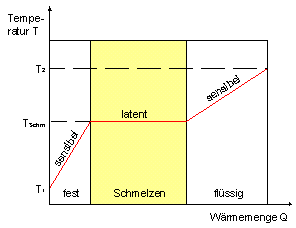
Phasenwechsel
Führt man einem
festen PCM Wärme zu, so beginnt dieses bei Erreichen seiner
Schmelztemperatur seinen Aggregatzustand von fest nach flüssig zu
ändern. Während dieses Phasenwechsels absorbiert das PCM eine
bestimmte Wärmemenge, die sogenannte Schmelzwärme. Da sich hierbei
die Temperatur des PCMs trotz Wärmezufuhr nicht ändert, spricht man
auch von latenter (versteckter) Wärme. Gleichermaßen wird im
umgekehrten Phasenwechsel, von flüssig nach fest, die gespeicherte
Latentwärme wieder bei konstanten Temperaturen abgegeben.
Vorteile latenter Wärme
Viele
Wärmespeicher wie z. B. der klassische Warmwasserspeicher nutzen nur die
sogenannte sensible Wärme, d. h. die durch eine Temperaturänderung
fühlbare Wärme. Die Wärmekapazität eines solchen Speichers
kann durch die folgende Gleichung bestimmt werden: Q = m · cp ·
delta T

Wärmespeicherkapazität
Der Vorteil eines PCMs liegt in der Nutzung der latenten Wärme
während des Phasenwechsels.
Ein geringerer, aber nicht zu
vernachlässigender Teil, wird als sogenannte sensible (fühlbare)
Wärme gespeichert. Daher sollte ein PCM auch gleichzeitig über eine
hohe spez. Wärmespeicherkapazität verfügen. Die spez.
Wärmekapazität von Wärmeparaffinen liegt bei etwa 2,1
kJ/(kg·K). Zusammen mit der Schmelzenthalpie von 180 bis 230 kJ/kg
ergeben sich für organische Stoffe sehr gute
Wärmespeichereigenschaften.
Ökologie
In den letzten Jahren hat sich das
Umweltbewusstsein der Menschen sehr stark gewandelt und die Kunden schauen
vermehrt auch auf die ökologischen Eigenschaften eines Produktes. Wärmeparaffine sind ökologisch unbedenkliche Stoffe und
nicht wassergefährdend gemäß Anhang I VwVws
(KBwS-Liste, Kenn-Nr. 268), ehemals Wassergefährdungsklasse 0. Sie sind
weder toxisch noch gesundheitsschädlich. Sie sind
recycelbar und biologisch abbaubar. Vollraffinierte Paraffine
entsprechen den deutschen (BgVV) und amerikanischen (FDA) Reinheitsvorschriften
für Produkte, die mit Lebensmitteln in Kontakt kommen. Aus den genannten
Gründen werden sie auch in der Lebensmittelindustrie (z. B. als
Käseumhüllung rote "Babybel" etc.) oder als Grundmaterial für
Cremes und Salben eingesetzt.
Der Handwärmer mit
Natriumacetattrihydrat
(Formel: NaCH3CO2 · 3H2O ;
Dichte g/cm3)
Kommt das unterkühlte Trihydrat mit einem Kristall
des Tryhydrats oder mit Luft in Verbindung, kristallisiert es. Beim
Kristallisieren wird Energie in Form von Wärme frei (160J/g). Die
Temperatur steigt bis zum Schmelzpunkt von 58°C. Im Handwärmer sind
etwa 110g Trihydrat enthalten, d.h. es werden etwa 110g x 160J/g = 18000 Joule
nutzbare Energie frei. Vermutlich initiieren Mikrorisse im Metallplättchen
den Kristallisationsprozess.
Beim Schmelzen wird das Natriumacetat in sein
Trihydrat umgewandelt.
http://www.physik.tu-muenchen.de:81/~kressier/Versuche/ver4166.html
Weitere gut unterkühlbare Substanzen
Fixiersalz (Natriumthiosulfat): schmilzt bei 48 °C und lässt sich
auf etwa 25 °C unterkühlen.
Glaubersalz (Natriumsulfat): schmilzt
bei 32,5 °C. Die Wärmeausbeute ist wegen des niedrigeren
Schmelzpunktes gering.
Magnesiumnitrat-Hexahydrat Mg(NO3)2 · 6 H2O:
mit einem Zusatz von Lithiumnitrat liegt der Schmelzpunkt dieser Mischung bei
70-80 °C und einer Wärmedichte von 182 J/cm3. Dies reicht aus, um nach
Auslösen der Kristallisation den Innenraum eines Autos samt Frontscheibe,
und manchmal sogar den Motor, aufzuheizen.
siehe
http://dc2.uni-bielefeld.de/dc2/tip/01_99.htm